Hver dag dør flere tusen personer av covid-19. Det haster derfor med å få på plass en effektiv koronavaksine. Siden begynnelsen av 2020, da den nye varianten av koronaviruset ble kjent, har det pågått et intensivt forsknings- og utviklingsarbeid, og i dag er over 200 vaksiner under utvikling. Tre av disse vurderes i øyeblikket (per 17. november 2020) av de europeiske legemiddelmyndighetene (EMA) for godkjenning, og minst sju av dem er aktuelle for Norge når eller hvis de blir godkjent.
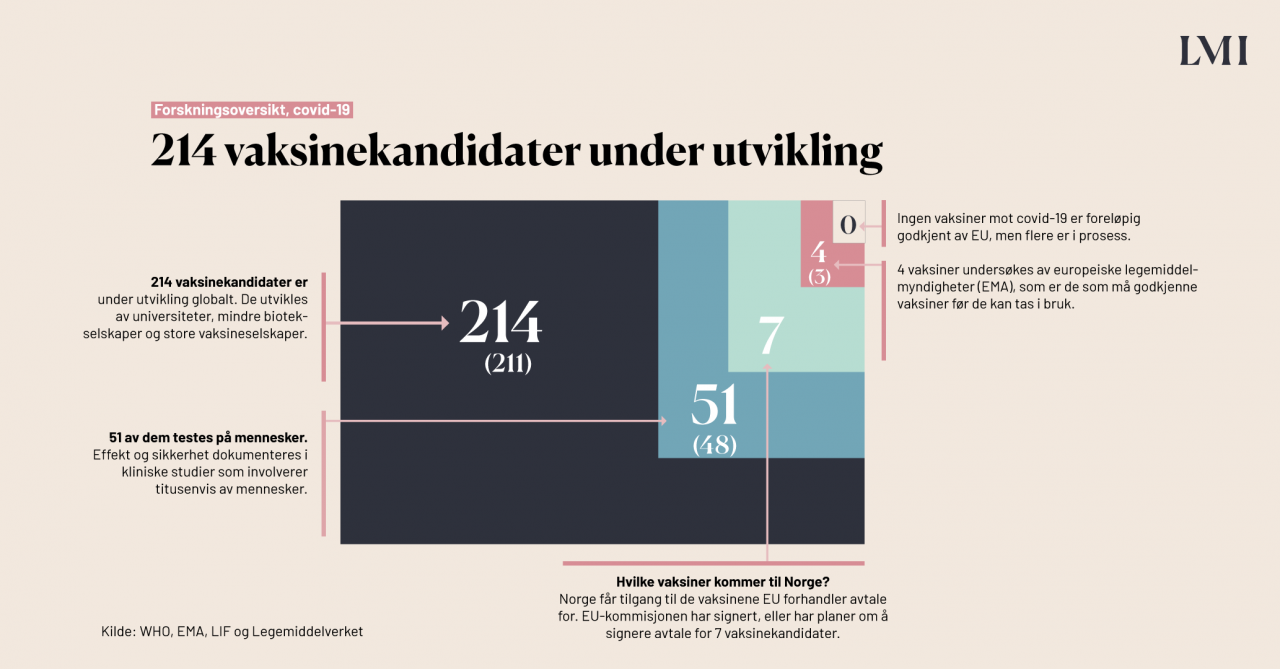
Globalt er over 200 vaksinekandidater mot covid-19 nå under utvikling. Av disse er 47 i den såkalte kliniske fasen, noe som betyr at de blir testet på mennesker. At det nå er så mange koronavaksine-kandidater under utvikling, og at alle er lansert etter årsskiftet, skyldes at akademia, legemiddelindustrien og ansvarlige myndigheter i fellesskap har prioritert denne vaksineforskningen. Det at den kan lanseres til markedet så fort skyldes samarbeid, ikke snarveier.
Se hele LMIs Tall og Fakta om covid-19-vaksinene her.
Q&A om koronavaksine
Hvor lang tid tar det vanligvis å utvikle en ny vaksine, og hvordan har man kunnet utvikle covid-19-vaksiner så raskt?
Det tar vanligvis mellom 5 og 15 år å utvikle en vaksine. Dette inkluderer grunnforskning, preklinisk forskning og kliniske studier i fase 1, 2 og 3. I tillegg tar selve produksjonen av vaksinene mellom 4 måneder og 3 år. Utviklingen av koronavaksiner, derimot, kan gå mye raskere fordi det pågår et utstrakt samarbeid mellom akademia, legemiddelprodusenter og myndigheter, og fordi prosedyrer er forkortet og effektivisert for å for å legge til rette for rask utvikling og godkjenning. Mange av prosessene utføres nå parallelt i stedet for i sekvens, slik man vanligvis må gjøre. Eksempelvis starter legemiddelfirmaene produksjon av vaksine før resultatene av kliniske studier er klare, og myndighetene evaluerer dokumentasjonen etter hvert som den blir tilgjengelig. Dette i motsetning i vanlige vaksineløp, der legemiddelfirmaene må samle opp til de har en komplett dokumentasjonspakke før de kan søke om godkjenning. De kliniske studiene kommer også raskere til en konklusjon når det er høy sykdomsaktivitet i samfunnet. I tillegg er enkelte av vaksinene utviklet med en relativt ny teknologi som gjør at de kan utvikles og produseres raskere enn tradisjonelle vaksiner; Vaksiner med levende virus som må dyrkes i celler tar lengre tid å produsere (6 mnd – 2 år) enn de nye RNA-vaksinene, som tar rundt 3 måneder. Kravene til kvalitet, sikkerhet og effekt er akkurat de samme som for andre vaksiner og legemidler. Disse strenge kravene settes ikke lavere for de kommende koronavaksinene. En vaksine blir bare godkjent dersom nytten vurderes som større enn risikoen.
Hva gjør legemiddelindustrien for å kunne utvikle en vaksine så raskt som mulig?
Vi vet at minst 73 legemiddelselskaper, både store globale og små biotekselskaper, er involvert i utviklingen av over 200 vaksinekandidater. Det er også flere universiteter og andre forskningsmiljøer. Flere av dem – både offentlige og private – samarbeider, og alle jobber intenst for å forske frem en effektiv og trygg vaksine mot covid-19. Av legemiddelselskapene som har kommet lengst i utviklingen av en vaksine mot covid-19 er Pfizer, AstraZeneca, Moderna og Johnson&Johnson/Janssen.
Når kan vi vente at vaksinene er klare for distribusjon?
Vi vet ikke nøyaktig når en trygg og effektiv vaksine vil være klar for distribusjon, siden ingen vaksiner foreløpig er godkjent. Men man anslår at det kan være i løpet av første halvår 2021. Før en eller flere covid-19-vaksiner kan distribueres, må man lykkes med en rekke viktige utfordringer:
– Vaksinene testes ut i store kliniske studier med tusenvis av frivillige personer inkludert.
– Det kreves en rekke uavhengige gjennomganger av sikkerhet og effekt, inkludert regulatorisk gjennomgang og godkjenning i landet der vaksinen er produsert. Det er Legemiddelverket som vurderer dokumentasjonen og godkjenner vaksiner for bruk i Norge i samarbeid med europeiske legemiddelmyndigheter (EMA).
– Vaksinene må produseres i store mengder, noe som vil være en enorm utfordring samtidig som man må fortsetter å produsere alle de andre viktige livreddende vaksinene som allerede er i bruk.
– Som et siste trinn vil vaksinene distribueres gjennom en kompleks logistikkprosess, med streng lager- og temperaturkontroll.
Hvilke typer vaksiner er under utvikling?
Flere ulike teknologier og plattformer prøves ut i de ulike prosjektene. Noen av vaksinene bruker kjent teknologi, mens andre bruker teknologi som ikke er brukt i humane vaksiner tidligere. Vaksinetypene kan deles inn i fire grupper: virusbaserte, proteinbaserte, virale vektorer og nukleinsyrebaserte vaksiner (DNA- og mRNA-vaksiner). Den sistnevnte teknologien er relativt ny. Statistikken viser at det er flest proteinbaserte vaksiner under utvikling mot covid-19, men av de fire som har kommet lengst i godkjenningsprosessen er to mRNA-vaksiner og to ikke-replikerende viral vektor-vaksiner. Les mer om de ulike vaksineteknologiene på nettsidene til Legemiddelverket.
Må alle vaksinene oppbevares i frysere?
Noen av vaksinene som utvikles kan oppbevares i kjøleskap, mens andre må oppbevares dypfryst på minus 70-80 grader. Pfizers vaksine må oppbevares på minus 75 grader, men tåler å stå 4-5 dager i kjøleskap etter opptining. Folkehelseinstituttet opplyser at kommuner ikke trenger å anskaffe ultrafryser på grunn av denne vaksinen, fordi de vil motta opptint vaksine som skal oppbevares i kjøleskap (2-8 °C).
Hvor effektive er vaksinene?
Av vaksinene som har kommet lengst, har de foreløpige studiene vist at noen har 70% effekt mot covid-19-sykdom, mens andre har vist 95 % effekt mot covid-19-sykdom. Til sammenligning har sesonginfluensavaksinene en gjennomsnittlig effekt på 60%. Noen har vist effekt mot mild sykdom, noen mot alvorlig sykdom. Det er foreløpig ikke vist at vaksinene beskytter mot smittespredning, og varighet av beskyttelse etter vaksinasjon er foreløpig ikke klarlagt. Les mer på fhi.no.
Hvor mange doser trenger man?
Det kommer an på vaksinen. For de fleste av vaksinene som utvikles trenger man to doser for å oppnå beskyttelse. Pfizers vaksine, for eksempel, gis i to doser med 21 dagers mellomrom. AstraZenecas og Modernas vaksiner gis i to doser med 28 dagers mellomrom, mens det foreløpig er usikkert om Janssens vaksine vil gis som én dose eller som to doser med 56 dagers intervall. Les mer på fhi.no.
Hvor lenge vil beskyttelsen av vaksinen vare?
Varighet av beskyttelse etter COVID-19-vaksiner er ukjent per i dag. Mer forskning er nødvendig for å svare på dette spørsmålet, og man må naturlig nok ta tiden til hjelp for å finne ut hvor lenge vaksinene eventuelt har effekt Det er imidlertid oppmuntrende at foreløpige data tyder på at de fleste som blir friske av COVID-19, utvikler en immunrespons som gir en viss beskyttelse mot reinfeksjon – selv om vi fremdeles ikke vet hvor lenge den varer. Det er heller ikke klart om gjentatt vaksinering mot COVID-19 vil være nødvendig i fremtiden.
Kan vaksinen stanse smitten?
Det er ukjent per i dag om vaksinene som er under utvikling vil beskytte mot selve koronainfeksjonen og dermed vil hindre smitte fra de vaksinerte. Det er ikke sikkert at alle vaksiner som utvikles i dag vil ha denne egenskapen. Det trengs mer forskning for å undersøke dette. Hovedhensikten med koronavaksinene er at de skal hindre alvorlig sykdom og død blant de vaksinerte. Selv etter at man har begynt å vaksinere, så må trolig de vanlige smittebeskyttende tiltakene fortsette i lang tid.
Vil vaksinene gi flokkimmunitet?
Generelt kan flokkimmunitet oppnås etter gjennomgått infeksjon hos en stor nok andel av befolkningen, eller ved vaksinasjon. Andelen av befolkningen som må være immune for å oppnå flokkimmunitet, varierer fra sykdom til sykdom. Når det gjelder covid-19-viruset, så vet vi foreløpig ikke om gjennomgått infeksjon eller vaksinering gir immunitet, og i så fall hvor lenge.
Hvordan godkjennes vaksinene?
Det er det europeiske legemiddelkontoret (EMA) som eventuelt godkjenner vaksinene etter å ha vurdert nytte og risiko på grunnlag av de kliniske studiene. EMA gjennomgår store mengder dokumentasjon/data. Hastegodkjenningen EMA gjør er en såkalt «rolling review» hvor myndighetene evaluerer data etter hvert som det blir tilgjengelig. Dette gjøres for at myndighetenes evalueringer skal gå hurtigere. Når en hel verden har behov for vaksinen holder det ikke at det én eller noen få produsenter får godkjent sine vaksiner. Her er det behov for mange vaksineprodusenter. Vaksinene godkjennes ikke på et mindre datagrunnlag, så godkjenningen er ikke mindre streng en normalt. Mange av prosessene utføres nå altså parallelt i stedet for i sekvens, slik man vanligvis må gjøre. Eksempelvis starter legemiddelfirmaene produksjon av vaksine før resultatene av kliniske studier er klare, og myndighetene evaluerer dokumentasjonen etter hvert som den blir tilgjengelig, i motsetning til at firmaene må samle opp til de har en komplett dokumentasjonspakke før de kan søke.
Gir vaksinene bivirkninger?
Alle legemidler og vaksiner kan gi bivirkninger, men de fleste er milde og forbigående. Vaksinene blir bare godkjent dersom de store studiene dokumenterer at nytten er større enn risikoen. Dersom studiene har 3000 studiedeltakere, regner man med å oppdage de mer sjeldne bivirkningene med en forekomst på 1 av 1000. Dersom studiene har 30 000 studiedeltakere, regner man med å oppdage svært sjeldne bivirkninger med en forekomst på 1 av 10 000, skriver Statens legemiddelverk. Koronavaksinestudiene som har kommet lengst har i gjennomsnitt 56 000 studiedeltakere.
Eventuelle bivirkninger som først oppstår lang tid etter vaksineringen, fanges opp i den kontinuerlige bivirkningsovervåkingen som er felles for alle vaksiner og legemidler. Dersom det da kommer flere meldinger om samme bivirkning, må myndighetene gjøre en vurdering. Hvis bivirkningen mest sannsynlig skyldes vaksinen, er det behov for tiltak, for eksempel råd om hvem som ikke bør få vaksinen.
Hvor mange vaksiner er under utvikling?
Over 200 vaksiner er i pipeline (under utvikling). Rundt 50 av disse testes nå ut i kliniske studier, noe som betyr at de testes på tusenvis av frivillige personer. Disse tallene oppdateres stadig, så følg gjerne med på lmi.no: Tall og fakta om covid-19-vaksinene, eller på WHOs oppdaterte oversikt.
Hvordan skal vaksinen nå ut til dem som trenger den mest? Og hvordan fordeles vaksinen?
Vaksinealliansen COVAX ble opprettet tidligere år, nettopp for å kunne sikre rettferdig fordeling av koronavaksiner. COVAX ledes av GAVI, Verdens helseorganisasjon og CEPI, og har som mål å sikre rask tilgang når en eller flere vaksiner er klare. Mer enn 75 land har så langt vist interesse for å slutte seg til vaksinealliansen, deriblant Norge, og en rekke legemiddelselskaper har signert intensjonsavtale med COVAX for å levere vaksiner til dem. COVAX skal også bidra til å akselerere utvikling og produksjon av COVID-19-vaksiner, samt diagnostikk og behandlinger, og garanterer rask og rettferdig tilgang til dem for mennesker i alle land. Den globale legemiddelindustrien har forpliktet seg til å sikre at vaksiner mot covid-19 vil være tilgjengelige for alle som trenger dem. Blant annet har AstraZeneca garantert at 64% av deres vaksiner skal gå til mennesker i utviklingsland. Industrien utvider produksjonskapasiteten sin og deler tilgjengelig kapasitet for å øke produksjonen – alt dette for å møte høy etterspørsel over hele verden. Fordelingen av vaksinene bestemmes av Verdens helseorganisasjon og hvert enkelt lands myndigheter.
Hvor mye skal vaksinene koste?
Legemiddelindustrien har forpliktet seg til å samarbeide med myndigheter og andre interessenter for å sikre at når nye vaksiner blir godkjent, vil de være tilgjengelige og rimelige over hele verden. COVAX har uttalt at en vaksine skal koste maks 40 dollar. Noen selskaper har bestemt at de ikke skal tjene penger på vaksinen overhodet, og kun ta betalt slik at de dekker produksjonskostnadene.
Hvordan kan man vite om vaksinen er trygg, når den er utviklet så mye raskere enn det som er vanlig?
Den raske utviklingen går ikke på bekostningen av sikkerhet og effekt. Årsaken til at det har kunnet gå så raskt er att det pågår et utstrakt samarbeid mellom akademia, legemiddelprodusenter og myndigheter, og fordi prosedyrer er forkortet og effektivisert for å for å legge til rette for rask utvikling og godkjenning. Mange av prosessene utføres nå parallelt i stedet for i sekvens, slik man vanligvis må gjøre. Eksempelvis starter legemiddelfirmaene produksjon av vaksine før resultatene av kliniske studier er klare, og myndighetene evaluerer dokumentasjonen etter hvert som den blir tilgjengelig. Dette i motsetning i vanlige vaksineløp, der legemiddelfirmaene må samle opp til de har en komplett dokumentasjonspakke før de kan søke om godkjenning. De kliniske studiene kommer også raskere til en konklusjon når det er høy sykdomsaktivitet i samfunnet. I tillegg er enkelte av vaksinene utviklet med en relativt ny teknologi som gjør at de kan utvikles og produseres raskere enn tradisjonelle vaksiner; Vaksiner med levende virus som må dyrkes i celler tar lengre tid å produsere (6 mnd – 2 år) enn de nye RNA-vaksinene, som tar rundt 3 måneder. Kravene til kvalitet, sikkerhet og effekt er akkurat de samme som for andre vaksiner og legemidler. Disse strenge kravene settes ikke lavere for de kommende koronavaksinene. En vaksine blir bare godkjent dersom nytten vurderes som større enn risikoen.
Hvilke bivirkninger kan man regne med?
Alle vaksiner har bivirkninger, de fleste er milde og forbigående. Når vaksiner utvikles, er målet alltid at de skal gi best mulig effekt med minst mulig bivirkninger. Selv om man tester de nye vaksinene grundig, vil man aldri kunne sikre seg helt mot sjeldne bivirkninger. Noen bivirkninger oppdages først når vaksinen tas i bruk, og gis til mange flere og mer varierte grupper enn i studiene. Vaksinene blir bare godkjent dersom de store studiene dokumenterer at nytten er større enn risikoen.
– Dersom studiene har 3000 studiedeltakere, regner man med å oppdage de mer sjeldne bivirkningene med en forekomst på 1 av 1000
– Dersom studiene har 30 000 studiedeltakere, regner man med å oppdage svært sjeldne bivirkninger med en forekomst 1 av 10 000, skriver Statens legemiddelverk.
– Koronavaksinestudiene som har kommet lengst har i gjennomsnitt 56 000 studiedeltakere.
Hva vet man om langtidsbivirkningene?
Det sier seg selv at man ikke kjenner langtidsbivirkningene før det har gått lang tid. Pandemien brøt ut for ett år siden, i desember 2019, og den første vaksinen ble testet ut på mennesker i mars 2020. Eventuelle bivirkninger som først oppstår lang tid etter vaksineringen, fanges opp i den kontinuerlige bivirkningsovervåkingen som er felles for alle vaksiner og legemidler. Dersom det da kommer flere meldinger om samme bivirkning, må myndighetene gjøre en vurdering. Hvis bivirkningen mest sannsynlig skyldes vaksinen, er det behov for tiltak, for eksempel råd om hvem som ikke bør få vaksinen. I sjeldne tilfeller kan vaksinen bli trukket fra markedet.
Hvor mange er vaksinene testet på?
Kliniske studier innebærer at medisiner eller vaksiner testes på et stort antall friske frivillige personer, slik at man kan fange opp både effekt og bivirkninger. For de 7 kandidatene som EU har forhandlet/forhandler med, har i gjennomsnitt 56 000 personer vært involvert i studiene. Til sammenligning har i gjennomsnitt 25 000 personer deltatt i vaksinestudiene for pneumokokksykdom, helvetesild, HPV og japansk encefalitt, ifølge WHO.
Har covid-vaksinene hoppet over dyreforsøk?
Nei. Du kan lese mer blant annet i artikkelen Status for vaksineutvikling mot covid-19 i Tidsskrift for Den norske legeforening, og om vaksinene til for eksempel Moderna, Pfizer og AstraZeneca. Ifølge en rapport fra Folkehelseinstituttet var det per 12. november 164 kandidater i pre-klinisk fase (laboratorie- og dyrestudier). Vaksinekandidatene valgt for Covid-19 er dessuten valgt ut fra plattformer som tidligere har blitt testet i dyremodeller mot andre koronavirus som SARS-CoV1- og MERS.
Utviklingen av en koronavaksine mot covid-19
Det tar normalt over ti år å utvikle en vaksine fra tidlig forskning til regulatorisk godkjenning, og deretter produksjon i stor skala. Med den massive innsatsen som nå blir gjort, og med fortløpende prosesser i alle faser, kan tiden bli betydelig kortere.
Smitteutbrudd
I desember 2019 ble det nye koronaviruset oppdaget, etter at folk i Kina fikk påvist lungebetennelse. Forskningsgrupper over hele verden begynte raskt sitt arbeid med å analysere viruset og dets egenskaper. Viruset ble senere kalt sars-CoV-2, mens sykdommen viruset forårsaker kalles covid-19.
Preklinisk Forskning og utvikling
Selskaper og akademia forsker på vaksiner. Farmasøytiske selskaper som spesialiserer seg på vaksiner bruker sine respektive ulike plattformer og tilnærminger de har utviklet gjennom årene for å få på plass vaksiner. Med innsatsen som har blitt initiert rundt det nye koronaviruset, går dette arbeidet raskere enn normalt.
Kliniske studier
En vaksine gjennomgår et klinisk studieprogram i tre faser på mennesker. Først på en mindre gruppe, og i fase 3 på tusenvis av mennesker. En koronavaksine må vise at det gir effektiv beskyttelse mot viruset, og at eventuelle bivirkninger er akseptable og uvanlige.
Godkjenningsprosess
Legemiddelselskapet må fremlegge omfattende dokumentasjon av en koronavaksine før søknad om tillatelse. Den ansvarlige myndigheten, som European Medicines Agency (EMA) i Europa, gjennomgår all dokumentasjon. Dersom evalueringen er positiv, er selskapet autorisert til å starte produksjon og salg av vaksinen.
Produksjon
En koronavaksine vil bli produsert i stor skala, kanskje hundre millioner doser. Produksjon i et sterilt miljø er svært komplisert og tidskrevende, med et stort antall kvalitetskontroller. All distribusjon opp til klinikken må gjøres med en ubrutt kjølekjede.
Vaksinasjon
Ved vaksinasjon skapes en reaksjon i kroppens immunforsvar etter noen uker. Immunforsvaret lærer å gjenkjenne viruset og skaper immunitet mot viruset. Dersom du blir smittet av viruset, aktiverer og dreper immunforsvaret viruset.

Koronavaksine – Hvorfor kan det gå raskere enn normalt?
Det er mange grunner til at man nå kan utvikle koronavaksine veldig hurtig og på en trygg måte:
– Det pågår et utstrakt samarbeid mellom akademia, legemiddelprodusenter og myndigheter.
– Mange av prosessene utføres nå parallelt i stedet for i sekvens, slik man vanligvis må gjøre. Eksempelvis starter legemiddelfirmaene produksjon av vaksine før resultatene av kliniske studier er klare, og myndighetene evaluerer dokumentasjonen etter hvert som den blir tilgjengelig, i motsetning til at firmaene må samle opp til de har en komplett dokumentasjonspakke før de kan søke.
– De kliniske studiene kommer også raskere til en konklusjon når det er høy sykdomsaktivitet i samfunnet.
– I tillegg er enkelte av koronavaksinene utviklet med en relativt ny teknologi som gjør at de kan utvikles og produseres raskere enn tradisjonelle vaksiner; En koronavaksine med levende virus som må dyrkes i celler tar lengre tid å produsere (6 mnd – 2 år) enn de nye RNA-vaksinene, som tar rundt 3 måneder.
Kravene til kvalitet, sikkerhet og effekt er akkurat de samme som for andre vaksiner og legemidler. De settes ikke lavere for de kommende koronavaksinene.
Se hele den store forskningsoversikten på covid-19-vaksiner her.
Lær om hele utviklingsløpet, og hvorfor prosessen med en koronavaksine kan gå raskere enn normalt her: