Behandlingene er basert på gener, vev eller celler, i motsetning til tradisjonelle legemidler som er basert på kjemiske eller biologiske forbindelser. Per mai 2020 er det 10 slike legemidler med markedsføringstillatelse i Europa, men flere hundre nye terapier testes ut i kliniske studier.
Her er noen eksempler på ATMP
Genterapi
Nytt genetisk materiale overføres til pasienten for å korrigere eller erstatte gener, modifisere genregulering, eller for å uttrykke nye gener som påvirker funksjon/overlevelse av cellene. Genterapi kan ha forebyggende, diagnostisk eller terapeutisk effekt og brukes i behandling av arvelige sykdommer, kreft og til vevsregenerering
Celleterapi
Modifiserte celler overføres til pasienten for å behandle sykdom ved hjelp av cellenes farmakologiske, immunologiske eller metabolske egenskaper
Vevsterapi
Modifiserte celler/vev blir gitt til pasienten for å reparere, regenerere eller erstatte ødelagt vev/organ
Kombinert ATMP
Betegnelsen brukes når ATMP er utviklet i kombinasjon med medisinsk teknisk utstyr som en integrert del av medisinen.
Hvilke sykdommer brukes ATMP mot?
ATMP kan brukes i behandling og diagnostikk av en rekke ulike sykdommer; alt fra kreft og hjertesykdom til tarmsykdom og øyesykdom. Ett eksempel på ATMP som brukes i Norge er CAR-T-terapi til behandling av enkelte typer blodkreft.

Er ATMP helt nytt?
Ja, ATMP er relativt nytt og representerer på mange måter et paradigmeskifte innen legemiddelfeltet, blant annet når det gjelder;
Klinisk utvikling og prosedyrer for testing
Produksjon
Administrering til pasient
Helseutbytte
Pris- og refusjonssystemet
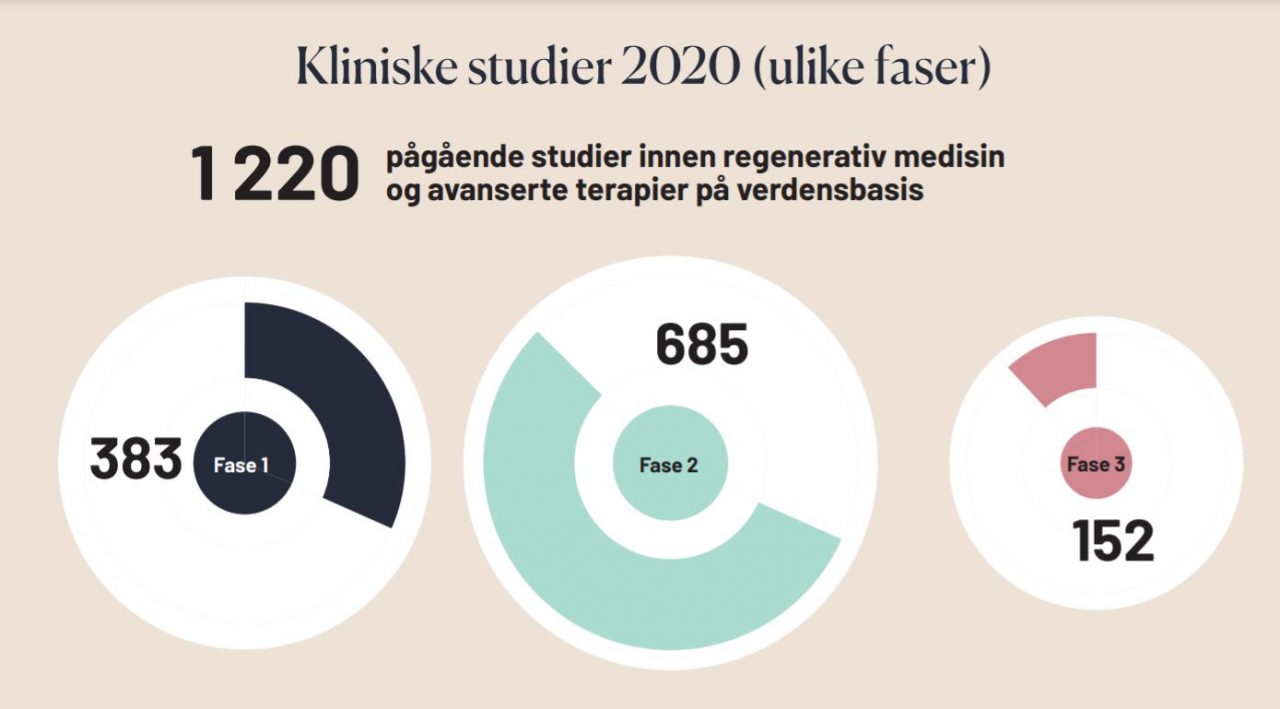
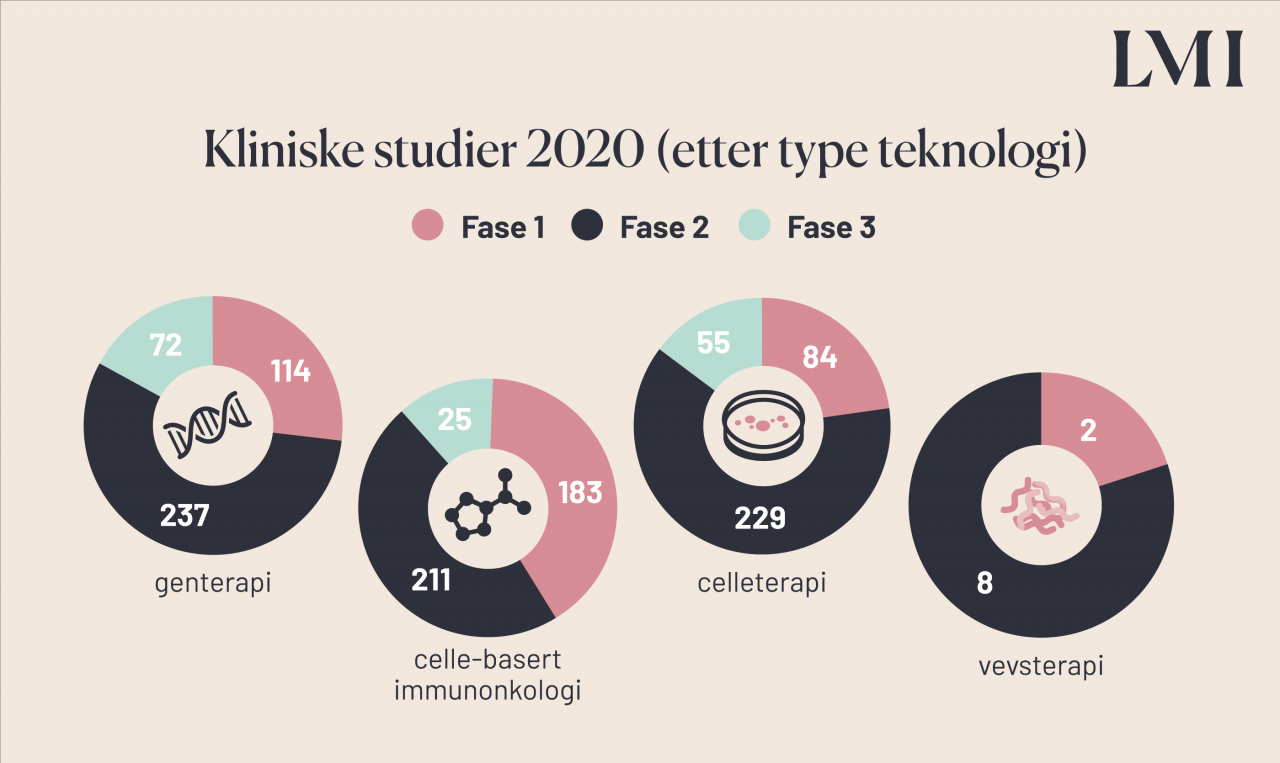
I perioden 2014-2018 var det globalt en økning i antall kliniske studier med ATMP på 32%. Europa hadde en 2% nedgang i denne perioden, mens antall kliniske studier i USA og Asia økte med henholdsvis 36% og 28%. Mot slutten av 2020 var det registrert over 1200 kliniske studier med ATMP globalt.
Hvordan ligger Norge an?
Norge er ikke best i klassen. Norge har lenge hatt en nedgang i kliniske studier generelt og vi ser at kun et fåtall av studiene på ATMP gjennomføres i Norge. I første halvdel av 2019 var det 9 kliniske studier med ATMP i Norge, mot 17 i Sverige og 19 i Danmark. Et velfungerende nasjonalt samarbeid mellom industrien, akademia og offentlige aktører (som Statens legemiddelverk og Regional etisk komité) er viktig for å bidra til at vi får kliniske studier på ATMP til Norge. Et godt eksempel på dette er innføringen av CAR-T-terapi.
Regulatoriske prosesser for å godkjenne avanserte terapier
Europeiske legemiddelmyndigheter (EMA) var de første legemiddelmyndighetene som utviklet spesifikke reguleringer, retningslinjer og veiledninger relatert til utvikling og godkjenning av ATMP. Første ATMP ble godkjent av EMA i 2009 og EMA hadde per 2019 godkjent flere ATMP enn noen annen region. I dag er det 10 ATMP godkjent for bruk i Europa.
Pris og tilgang
En utfordring med godkjenningen av nye ATMP er at de etablerte systemene for vurdering og godkjenning av offentlig finansiering ikke er utformet med tanke på denne typen behandlinger. Det er behov for å utvikle nye metoder for vurdering og finansiering av disse medisinene.
Det er mange årsaker til at ATMP utfordrer dagens refusjonssystem. ATMP vurderes ofte på et mindre datagrunnlag sammenliknet med andre terapiområder på grunn av små pasientpopulasjoner og utfordringer knyttet til rekruttering av pasienter til kliniske studier, inkludert kontrollgrupper. Real-World Data (RWD) og fase 4 studier er derfor av stor betydning for ATMP. I motsetning til konvensjonelle medisiner hvor vurdering av kostnader og nytte begrenses til behandlingsvarighet, innebærer ATMP ofte en høy éngangsbetaling – fordi det gjerne er en éngangs-behandling – og effekten av behandlingen kan strekke seg utover mange år (med potensielt livslang og/eller kurativ effekt).
Til tross for ofte høye kostnader, har behandlingene potensielt stor effekt for pasienter, pårørende og samfunn. Verdifulle effekter kommer også i form av besparelser for samfunnet på fremtidige behandlinger, støtte og tilrettelegging, samt gjennom økt livskvalitet og produktivitet for pasienter og pårørende. Dagens tradisjonelle system tar i liten grad dette med i vurdering av nye legemidler.
Finnes det løsninger for å få tilgang?
Industri og myndigheter i mange land jobber for å finne løsninger som alle parter kan enes om. Her er tre mulige løsninger:
Midlertidig, betinget refusjon. Her samles data over tid og vurderes fortløpende og over tid. Nye prisforhandlinger gjøres basert på innsamlede data. Eksempel på land som praktiserer dette: Storbritannia, Skottland.
Betal bare hvis det virker (Pay for Perfomance/Verdibaserte prisavtaler). Her er pris og eventuelle rabatter satt etter forhåndsbaserte resultatmål. Dersom behandlingen viser seg å ha den effekten man forventet, betales produsenten for dette. Viser det seg at effekten er dårligere enn forventet, reduseres prisen. Det kan imidlertid være utfordrende å følge effekten over tid dersom det er mange pasienter og mange behandlinger, men enklere ved få pasienter eller få behandlinger per pasient.
Betaling fordelt over flere år («abonnement»). Kostnadene fordeles og risikoen spres. Det finnes ingen eksempler på land som har innført dette per nå.