Tallene fra den årlige WAIT-rapporten gjennomført av analyseselskapet IQVIA på oppdrag fra EFPIA viser at Norge ligger bak Sverige, Finland og Danmark når det gjelder antall nye legemidler som er godkjent for offentlig finansiering, og tiden det tar for å tilgjengeliggjøre legemidler til norske pasienter.

– Dette er svært urovekkende og en utvikling som vi ikke ønsker, sier Karoline Knutsen og Katrine Bryne som leder markedstilgangsarbeidet i LMI.
Det er den europeiske legemiddelindustriforeningen, EFPIA, som bestiller den årlige rapporten, Waiting to Access Innovative Therapies (WAIT) om tilgang til legemidler i Europa. Rapporten gjennomføres av analyseselskapet IQVIA. Rapporten har blitt utgitt siden 2004 og er den største europeiske studien som omhandler tilgang til innovative legemidler og tiden det tar før pasienter får tilgang. I publikasjonen er det data fra 38 land (27 EU og 11 ikke-EU), dette gir et godt bilde av tilgjengelighet til nye medisiner i Europa.
Det er bransjeforeningene for legemiddelindustrien i de ulike landene som har bidratt med innhenting av tall, og LMI har sendt inn tall fra Norge. Tallene er hentet fra Nye metoder og Statens Legemiddelverk. Det er viktig å presisere at rapporten ser på antall nye legemidler (substanser) godkjent av European Medicines Agency (EMA) og at publikasjonen som er utgitt i år ser på perioden 2017 til 2020.
Her er noen hovedfunn fra rapporten:
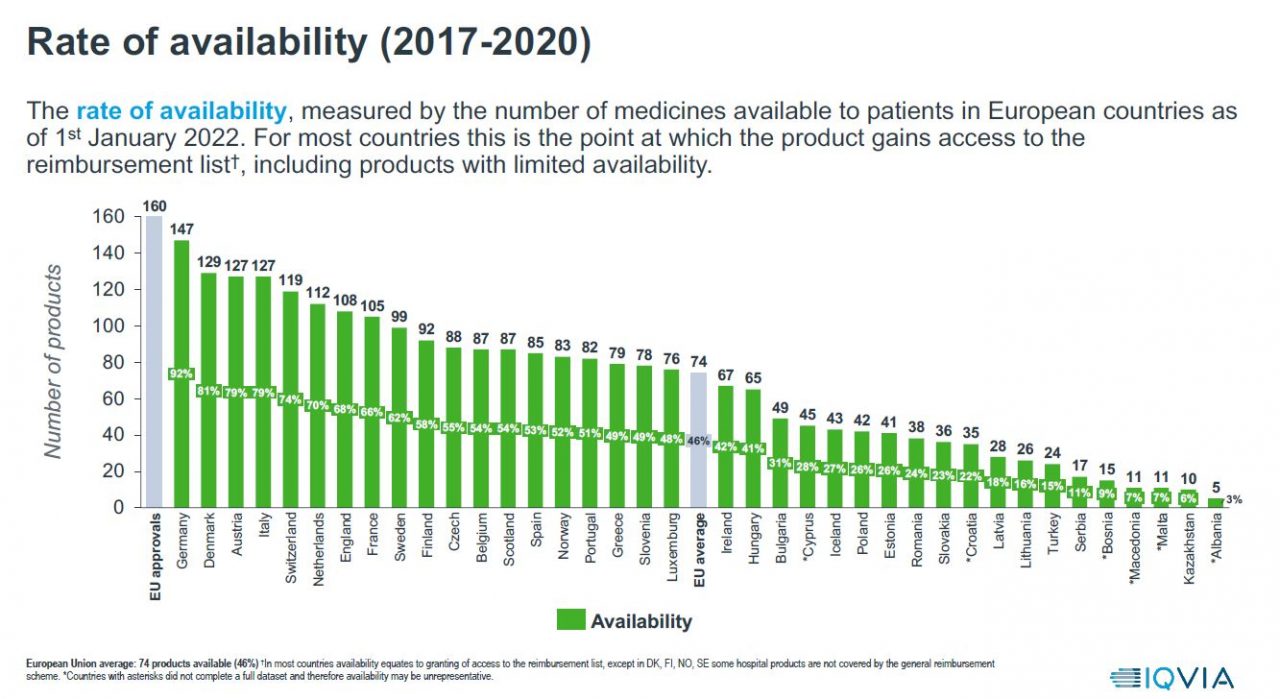
Rate of availability: Figur 1 nedenfor viser tilgjengeligheten til nye medisiner i europeiske land som har fått markedsføringstillatelse (MT) i EMA i perioden 2017-2020, der tilgjengelighet defineres som tidspunktet nytt legemiddel blir godkjent for offentlig finansiering etter at legemiddelet har fått markedsføringstillatelse av EMA. I Norge er 52 prosent (83 nye legemidler) av alle nye legemidler godkjent av EMA i perioden 2017 – 2020 tilgjengelig gjennom offentlig finansiering. Til sammenligning er 82 prosent (129 legemidler) tilgjengelig i Danmark, 62 prosent (99 nye produkter) i Sverige og 58 prosent (92 nye legemidler) i Finland. Av 45 nye legemidler godkjent i EMA i 2020 er det kun 12 som er godkjent for finansiering i Norge, 73 prosent er ikke tilgjengelig for norske pasienter.
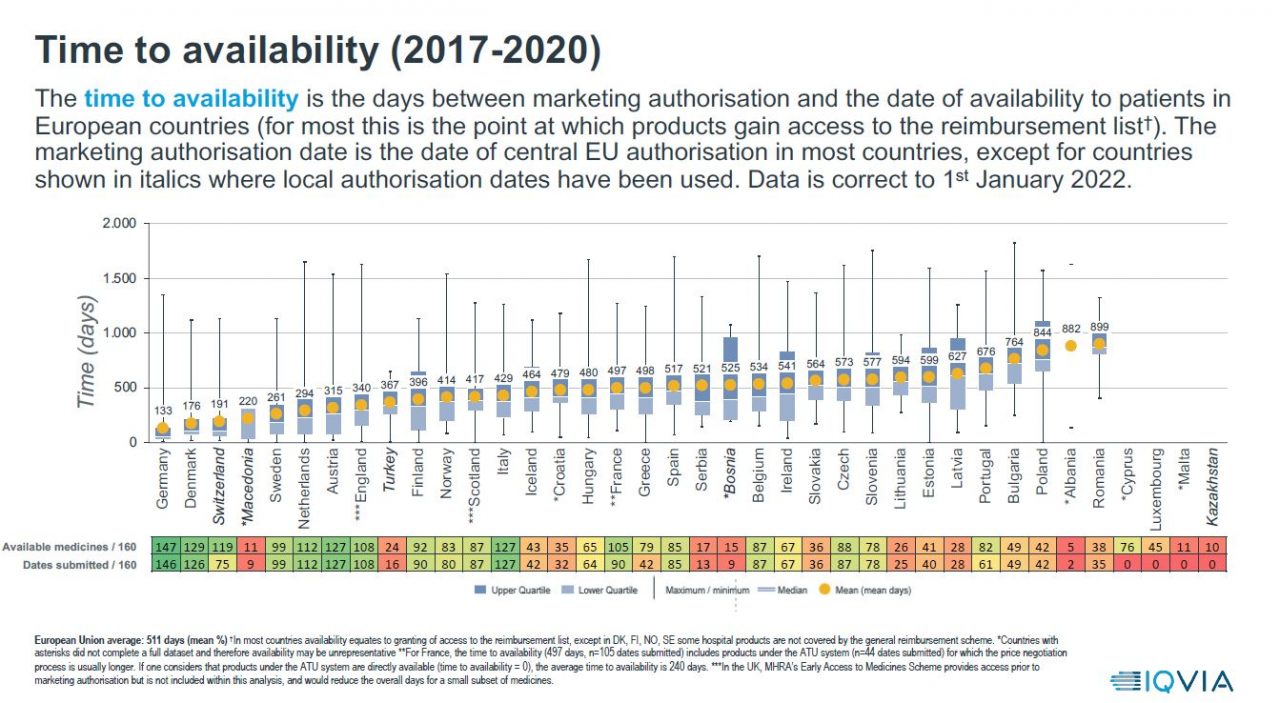
Time to availability: Tiden det tar før nye legemidler er tilgjengelig for pasienter er her målt i antall dager fra utstedt markedsføringstillatelse (MT) av EMA til datoen for tilgjengelighet for pasienter i de enkelte Europeiske landene (for de fleste er dette da produktet får godkjent opptak på refusjonslisten). Her ser vi at det i Norge tar hele 414 dager fra godkjent MT i EMA til pasienter får tilgang. I Danmark tar det til sammenligning 176 dager, i Sverige 261 dager og i Finland 396 dager. Det tar altså over dobbelt så lang tid for pasienter i Norge å få tilgang til nye behandlinger, sammenlignet med pasienter i Danmark.
– Tallene fra årets EFPIA Patient W.A.I.T.-analyse viser ikke et godt bilde for norske pasienter, og føyer seg inn i rekken av flere tidligere analyser (ref.) som også viser at Norge er en sinker ved å ta i bruk nye medisiner. Evalueringen av Nye metoder konkluderte også at Norge tar i bruk medisiner senere enn andre land, sier Bryne og Knutsen.
– Dette er en uheldig utvikling. For norske pasienter er det svært kritisk at det tar over ett år fra Europeiske legemiddelmyndigheter har godkjent en ny medisin til at de kan få tilgang gjennom offentlig finansiering. Videre mener vi også at det er bekymringsverdig at flere nye innovasjoner ikke er tilgjengelig for norske pasienter i dag ved at de ikke oppnår offentlig finansiering. Det er et ensidig fokus på lavest mulig pris, noe som medfører en forsinket og begrenset tilgang til nye innovasjoner for norske pasienter, sier Bryne og Knutsen.