Norge ligger nå på 15. plass i Europa med 51 % tilgang til nye legemidler
Norge har i 2018-undersøkelsen blitt forbigått av Frankrike, Tsjekkia og Slovenia, sammenlignet med fjorårets undersøkelse. Hellas ligger nå også foran Norge, men var ikke med i 2017-undersøkelsen. Tiden det tar fra et legemiddel får markedsføringstillatelse til det får tilgang har økt med 42 dager (14%); fra 291 dager i 2017- til 333 dager i 2018-undersøkelsen.
Det er den europeiske legemiddelindustriforeningen EFPIA som hvert år utarbeider en rapport om tilgang til legemidler i Europa: Patient WAIT Indicator.
Her er et utdrag av hva rapporten viser:
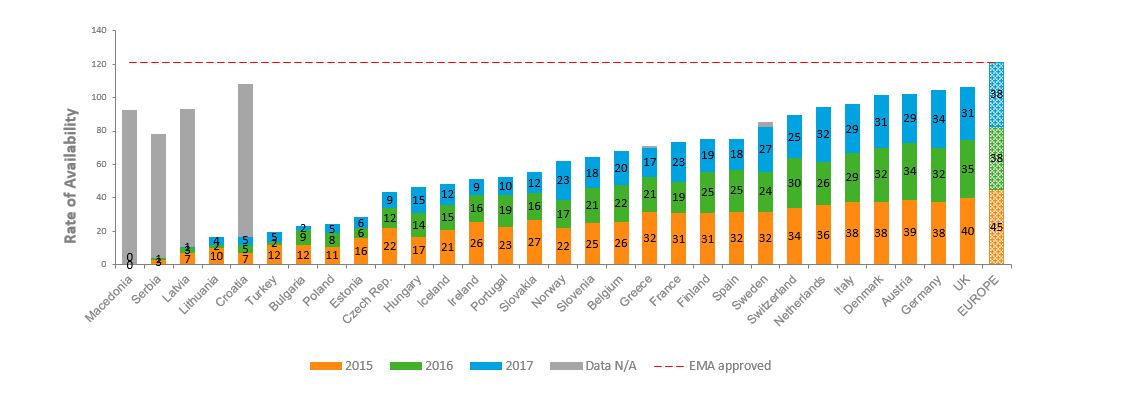
Figur 1 nedenfor viser antall legemidler med markedsføringstillatelse fra årene 2015, 2016 og 2017 som har fått tilgang i hvert land, sammenlignet med antall legemidler som har fått markedsføringstillatelse av EMA i Europa.
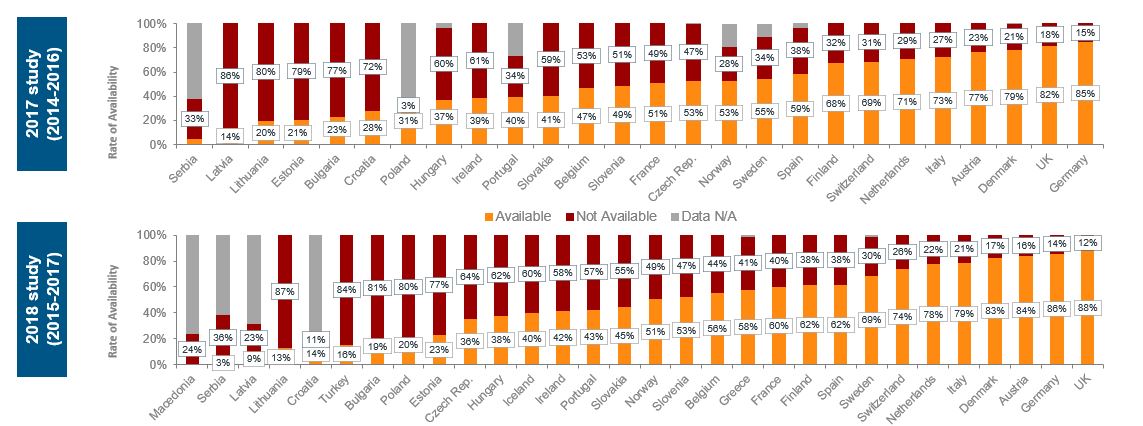
Figur 2 nedenfor viser legemidler som har fått markedsføringstillatelse i løpet av to treårsperioder; 2014 – 2016 og 2015 – 2017, og i hvilken grad disse legemidlene har fått tilgang i hvert enkelt land. I 2017-undersøkelsen var Norge på 11. plass med 53% tilgang, mens Norge i 2018-undersøkelsen er på 15. plass med 51% tilgang. Norge har i den siste undersøkelsen blitt forbigått av Frankrike, Tsjekkia og Slovenia. Hellas ligger også foran Norge. Dette landet var med for første gang i 2018-undersøkelsen.
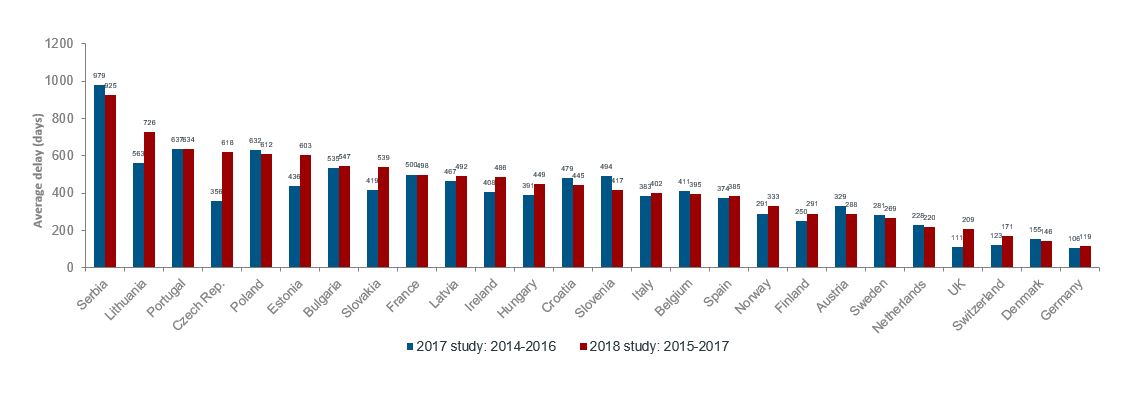
Den gjennomsnittlige tiden det tar fra et legemiddel får markedsføringstillatelse til det får tilgang, har økt fra 291 til 333 dager fra 2017- til 2018-undersøkelsen, ifølge figur 3, nedenfor. Dette er en økning på 42 dager, eller 14%.
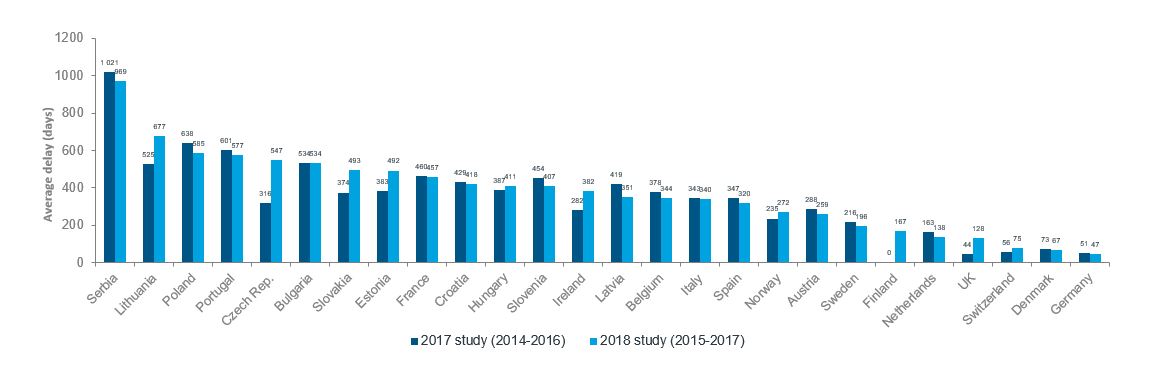
Median tid fra markedsføringstillatelse til tilgang har økt fra 235 til 272 dager fra 2017- til 2018-undersøkelsen. Økningen er på 37 dager, eller 16%, viser figur 4, nedenfor.
Se hele rapporten:
EFPIA Patient W.A.I.T. Indicator 2018 survey
Kilde: EFPIA W.A.I.T Indicator Study 2018, utført av IQVIA